طاقة الارتباط من ويكيبيديا، الموسوعة الحرة
الروابط مفعلة الي ويكبيديا مصدر الروابط والموضوع
فيزياء نووية
نشاط إشعاعي
انشطار نووي
اندماج نووي
اضمحلال تقليدي
.تحلل ألفا
· تحلل بيتا
· أشعة غاما
اضمحلال متطور
اضمحلال بيتا المضاعف ·
الروابط مفعلة الي ويكبيديا مصدر الروابط والموضوع
فيزياء نووية

نشاط إشعاعي
انشطار نووي
اندماج نووي
اضمحلال تقليدي
.تحلل ألفا
· تحلل بيتا
· أشعة غاما
اضمحلال متطور
اضمحلال بيتا المضاعف ·
طاقة الارتباط في علم الفيزياء هي طاقة قوية تربط الجسيمات النووية في النواة بعضها ببعض وهي ذات مدى قصير حيث لا يبدأ الجسيمين بالتجاذب بين بعضهما إلا بعد أن يكونا على بعد 4 × 10 − 15 {\displaystyle 4\times 10^{-15}}  متراً ( 4 × 10 − 5 {\displaystyle 4\times 10^{-5}}
متراً ( 4 × 10 − 5 {\displaystyle 4\times 10^{-5}} 
 متراً ( 4 × 10 − 5 {\displaystyle 4\times 10^{-5}}
متراً ( 4 × 10 − 5 {\displaystyle 4\times 10^{-5}} 
أنجستروم) تقريباً . وتلك الطاقة تزداد بشدة باقتراب البروتونات والنيوترونات في نواة الذرة من بعضهم البعض. قوة ارتباط البروتونات والنيوترونات في نواة الذرة شديدة جدا أشد كثيرا من قوة التجاذب الناشيء عن الثقالة (الجاذبية) ، ومداها قصير جداد جدا كما ذكرنا أعلاه ، بعكس قوة الثقالة التي هي بعيدة المدى .
الطاقة الكلية للنواة المترابطة تكون دوماً "أقل" من مجموع الطاقات لكل جسيم نووي على حدة. وهذا الفرق في الطاقة يعرف بانه طاقة الارتباط . لذا يمكن تعريف طاقة الارتباط بشكل أخر ،ألا وهي الطاقة اللازمة لفصل الجسيمات النووية في النواة عن بعضها.
فإذا غادرنا النواة بما فيها من بروتونات ونيوترونات مترابطة ببعضها البعض ، ونظرنا إلى الذرة نفسها بتكوينها من نواة وإلكترونات تدور حولها في غلاف من المدارات ، نجد أن الالكترونات أيضا ترتبط بالنواة ، ذلك لأن الإلكترون سالب الشحنة والنواة تكون موجبة الشحنة . طاقة الارتباط بين الإلكترون والنواة هي طاقة كولوم وهي كهربائية (أو بصفة أدق كهرومغناطيسية) وتسمى قوة كهرومغناطيسية وهي بعيدة المدى . أما قوة ارتباط البروتونات والنيوترونات في النواة فتسمى قوة نووية وهي قصيرة المدى جدا جدا.
الطاقة الكلية للنواة المترابطة تكون دوماً "أقل" من مجموع الطاقات لكل جسيم نووي على حدة. وهذا الفرق في الطاقة يعرف بانه طاقة الارتباط . لذا يمكن تعريف طاقة الارتباط بشكل أخر ،ألا وهي الطاقة اللازمة لفصل الجسيمات النووية في النواة عن بعضها.
فإذا غادرنا النواة بما فيها من بروتونات ونيوترونات مترابطة ببعضها البعض ، ونظرنا إلى الذرة نفسها بتكوينها من نواة وإلكترونات تدور حولها في غلاف من المدارات ، نجد أن الالكترونات أيضا ترتبط بالنواة ، ذلك لأن الإلكترون سالب الشحنة والنواة تكون موجبة الشحنة . طاقة الارتباط بين الإلكترون والنواة هي طاقة كولوم وهي كهربائية (أو بصفة أدق كهرومغناطيسية) وتسمى قوة كهرومغناطيسية وهي بعيدة المدى . أما قوة ارتباط البروتونات والنيوترونات في النواة فتسمى قوة نووية وهي قصيرة المدى جدا جدا.
وتقاس طاقة ارتباط الإلكترون بوحدة إلكترون فولت.
فطاقة الارتباط لإلكترون في المدار 1 s {\displaystyle 1s}  تتناسب مع ( Z − 1 ) 2 {\displaystyle (Z-1)^{2}}
تتناسب مع ( Z − 1 ) 2 {\displaystyle (Z-1)^{2}}  حسب قانون موزلي. حيث Z {\displaystyle Z}
حسب قانون موزلي. حيث Z {\displaystyle Z}  هي الرقم الذري. وتبلغ طاقة ارتباط الإلكترون في ذرة الهيدروجين 7و13 كيلو إلكترون فولت.
هي الرقم الذري. وتبلغ طاقة ارتباط الإلكترون في ذرة الهيدروجين 7و13 كيلو إلكترون فولت.
 تتناسب مع ( Z − 1 ) 2 {\displaystyle (Z-1)^{2}}
تتناسب مع ( Z − 1 ) 2 {\displaystyle (Z-1)^{2}}  حسب قانون موزلي. حيث Z {\displaystyle Z}
حسب قانون موزلي. حيث Z {\displaystyle Z}  هي الرقم الذري. وتبلغ طاقة ارتباط الإلكترون في ذرة الهيدروجين 7و13 كيلو إلكترون فولت.
هي الرقم الذري. وتبلغ طاقة ارتباط الإلكترون في ذرة الهيدروجين 7و13 كيلو إلكترون فولت.
^
منحني طاقة الارتباط وتغيرها بتغير العدد الذري للنواة. أكبر فرق في طاقة الارتباط نجده بين الهيدروجين H {\displaystyle \mathrm {H} }  والهيليوم H e − 4 {\displaystyle \mathrm {He-4} }
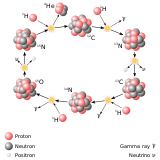
والهيليوم H e − 4 {\displaystyle \mathrm {He-4} }  ، عندما يندمج الهيدروجين مكونا الهيليوم . هذا التفاعل هو مصدر طاقة الشمس والنجوم. وتستغله القنبلة الهيدروجينية الفظيعة .
، عندما يندمج الهيدروجين مكونا الهيليوم . هذا التفاعل هو مصدر طاقة الشمس والنجوم. وتستغله القنبلة الهيدروجينية الفظيعة .
 والهيليوم H e − 4 {\displaystyle \mathrm {He-4} }
والهيليوم H e − 4 {\displaystyle \mathrm {He-4} }  ، عندما يندمج الهيدروجين مكونا الهيليوم . هذا التفاعل هو مصدر طاقة الشمس والنجوم. وتستغله القنبلة الهيدروجينية الفظيعة .
، عندما يندمج الهيدروجين مكونا الهيليوم . هذا التفاعل هو مصدر طاقة الشمس والنجوم. وتستغله القنبلة الهيدروجينية الفظيعة .
في الفيزياء النووية تعرف قوة الارتباط بأنها الطاقة التي تتحرر عندما يأتي نوكليون إلى النواة ويلتحم فيها. وتكون تلك الطاقة طبقا لتكافؤ الكتلة والطاقة : E = m c 2 {\displaystyle E=mc^{2}}  مصحوبة بنقص في الكتلة الكلية ، يسمى نقص الكتلة.
مصحوبة بنقص في الكتلة الكلية ، يسمى نقص الكتلة.
 مصحوبة بنقص في الكتلة الكلية ، يسمى نقص الكتلة.
مصحوبة بنقص في الكتلة الكلية ، يسمى نقص الكتلة. أي أنه على سبيل المثال : تتكون نواة الهيليوم من بروتونين ونيوترونين ، فيكون عددها الذري 4 . هذا الوزن يكون فعليا "أقل قليلا " من 4 u {\displaystyle 4u}
 للنواة المترابطة عن أوزان الأربعة جسيمات منفردة . يرجع نقص الكتلة هذا إلى ترابط الجسيمات بعضها البعض ، حيث u {\displaystyle u}
للنواة المترابطة عن أوزان الأربعة جسيمات منفردة . يرجع نقص الكتلة هذا إلى ترابط الجسيمات بعضها البعض ، حيث u {\displaystyle u}  وحدة كتل ذرية.
وحدة كتل ذرية. يتسبب جزء من قوى التآثر القوي في ربط مكونات نواة الذرة من بروتونات ونيوترونات (نوكليونات) مع بعضها البعض . وتعمل ضدها قوة التنافر التي تسببها الشحنات الموجبة للبروتونات طبقا لقانون كولوم فتضعف قوي التجاذب قليلا.
تبين بالبحث العلمي أن البروتون والنيوترون كل منهما مركب من ثلاثة كواركات مختلفة ، وهي جسيمات أولية تفترضها النظرية ، وتربطها قوى التآثر القوي وهي أقوى قوة رابطة نعرفها من ضمن أربعة قوى أساسية تتحكم في الطبيعة ، وهي قوة نووية ضعيفة وتآثر كهرومغناطيسي والجاذبية بالإضافة إلى التآثر القوي.
يبين الشكل تغير متوسط قوة الارتباط لكل نيوكليون في النواة بتغير الكتلة الذرية للعناصر . نجد من بينها أن طاقة الارتباط كبيرة في الهيليوم-4 وهو أشد الأنوية الذرية تماسكا ، وتعرف أيضا بأنها جسيمات ألفا التي تتكون من بروتونين ونيوترونين . بعده تقل قوة الارتباط نسبيا بنشأة الليثيوم-6 ، ثم تزيد حتى تصل إلى قمة ثانية تمثل طاقة ارتباط نواة الكربون-12 ، وتهبط قليلا بزيادة العدد الذري ثم تزيد حتى تصل إلى نهاية عظمى ثالثة في الأكسجين-16 . وبعدها تتغير طاقة الارتباط لكل نوكليون في النواة الذرية تغيرا طفيفا حتى نصل إلى أثقل العناصر اليورانيوم. أي أن رابطة البروتون في نواة الهليوم أقوى كثيرا من رابطته في نواة أي عنصر آخر بما فيها اليورانيوم-235 الذي تصنع منه القنبلة الذرية .
وصف منحنى طاقة الارتباط للعناصر
تصل أكبر طاقة ارتباط لكل نوكليون في نواة الحديد F e {\displaystyle \mathrm {Fe} }
 وتبدأ في الانخفاض قليلا ومستمرا بزيادة العدد الذري للعنصر (الجزء الأفقي للمنحنى) : فكلما زاد عدد البروتونات تزداد تبعا قوي التنافر الكهربي المتسببة عن الشحنات الموجبة للبروتونات. لذلك يمكن استغلال طاقة الارتباط في إنتاج الطاقة من العناصر الخفيفة بواسطة الاندماج النووي حيث يندمج الهيدروجين مكونا الهيليوم-4 . كما يمكن استعلال فقد الكتلة في انتاج الطاقة من العناصر الثقيلة مثل اليورانيوم والثوريوم بواسطة الانشطار النووي حيث تنقسم نواة اليورانيوم-235 إلى نواتين صغيرتين . قد تبلغ الكتلة الذرية لكل منهما نحو 117 وحدة كتل ذرية ويصدر فرق قوة الارتباط في صورة طاقة نووية ، نستغلها في توليد الكهرباء في مفاعل نووي أو في صناعة القنابل النووية الشديدة الانفجار .
وتبدأ في الانخفاض قليلا ومستمرا بزيادة العدد الذري للعنصر (الجزء الأفقي للمنحنى) : فكلما زاد عدد البروتونات تزداد تبعا قوي التنافر الكهربي المتسببة عن الشحنات الموجبة للبروتونات. لذلك يمكن استغلال طاقة الارتباط في إنتاج الطاقة من العناصر الخفيفة بواسطة الاندماج النووي حيث يندمج الهيدروجين مكونا الهيليوم-4 . كما يمكن استعلال فقد الكتلة في انتاج الطاقة من العناصر الثقيلة مثل اليورانيوم والثوريوم بواسطة الانشطار النووي حيث تنقسم نواة اليورانيوم-235 إلى نواتين صغيرتين . قد تبلغ الكتلة الذرية لكل منهما نحو 117 وحدة كتل ذرية ويصدر فرق قوة الارتباط في صورة طاقة نووية ، نستغلها في توليد الكهرباء في مفاعل نووي أو في صناعة القنابل النووية الشديدة الانفجار . البروزات الموجودة على المنحني فهي ترجع إلى ما يسمى الاعداد السحرية magic numbers ، وهي أنوية ذرات شديدة التماسك يصعب فصل محتوياتها ويحدث ذلك طبيعيا عند أعدادا معينة سواء للبروتونات أو النيوترونات ، لا يعرف تفسير لها حتى الآن ولذلك تسمى الأعداد السحرية.
وتعرّف قوة الارتباط B {\displaystyle B}
 باستخدام الكتلة الذرية نظرا لسهولة تعيينها عمليا ، عن تعيين كتلة النواة الذرية : B ( Z , A ) = ( Z ⋅ M ( H ) + ( A − Z ) ⋅ M ( n ) − M ( A , Z ) ) ⋅ c 2 {\displaystyle B(Z,A)=\left(Z\cdot M(H)+(A-Z)\cdot M(n)-M(A,Z)\right)\cdot c^{2}}
باستخدام الكتلة الذرية نظرا لسهولة تعيينها عمليا ، عن تعيين كتلة النواة الذرية : B ( Z , A ) = ( Z ⋅ M ( H ) + ( A − Z ) ⋅ M ( n ) − M ( A , Z ) ) ⋅ c 2 {\displaystyle B(Z,A)=\left(Z\cdot M(H)+(A-Z)\cdot M(n)-M(A,Z)\right)\cdot c^{2}} 
حيث: M ( H ) {\displaystyle M(H)}
 كتلة ذرة الهيدروجين , M ( n ) {\displaystyle M(n)}
كتلة ذرة الهيدروجين , M ( n ) {\displaystyle M(n)}  كتلة النيوترون, M ( A , Z ) {\displaystyle M(A,Z)}
كتلة النيوترون, M ( A , Z ) {\displaystyle M(A,Z)}  كتلة نواة فيها عدد Z {\displaystyle Z}
كتلة نواة فيها عدد Z {\displaystyle Z}  من البروتونات وعدد A {\displaystyle A}
من البروتونات وعدد A {\displaystyle A}  من النوكليونات (بروتونات ونيوترونات). ( A {\displaystyle A}
من النوكليونات (بروتونات ونيوترونات). ( A {\displaystyle A}  الكتلة الذرية و Z {\displaystyle Z}
الكتلة الذرية و Z {\displaystyle Z}  العدد الذري).
العدد الذري). ويرجع صيغة قوة الارتباط في نواة الذرة إلى نموذج القطرة طبقا ل معادلة بيته-فايتزيكر.
ينتج عن نقص الكتلة عند انشطار نواة ذرة اليورانيوم-235 نحو 200 مليون إلكترون فولت من الطاقة .
اقرأ أيضا
نقص الكتلة
تفاعل نووي
انشطار نووي
نموذج القطرة
نموذج غلاف نووي
معادلة نصف تجريبية للكتلة
فيزياء نووية
مادة كوارك





ليست هناك تعليقات:
إرسال تعليق